| Fruktosa-bisfosfat aldolase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Oktamer fruktosa-bisfosfat aldolase, manusia | |||||||||
| Pengenal pasti | |||||||||
| Nombor EC | 4.1.2.13 | ||||||||
| Nombor CAS | 9024-52-6 | ||||||||
| Pangkalan data | |||||||||
| IntEnz | Lihat IntEnz | ||||||||
| BRENDA | Entri BRENDA | ||||||||
| ExPASy | Lihat NiceZyme | ||||||||
| KEGG | Entri KEGG | ||||||||
| MetaCyc | Laluan metabolik | ||||||||
| PRIAM | Profil | ||||||||
| Struktur PDB | RCSB PDB PDBj PDBe PDBsum | ||||||||
| Ontologi gen | AmiGO / EGO | ||||||||
| |||||||||
| Fruktosa-bisfosfat aldolase kelas I | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Fruktosa 1,6-bisfosfat aldolase; hati arnab | |||||||||
| Pengenal pasti | |||||||||
| Simbol | Glycolytic | ||||||||
| Pfam | PF00274 | ||||||||
| InterPro | IPR000741 | ||||||||
| PROSITE | PDOC00143 | ||||||||
| SCOP | 1ald | ||||||||
| SUPERFAMILY | 1ald | ||||||||
| CDD | cd00344 | ||||||||
| |||||||||
| Fruktosa-bisfosfat aldolase kelas II | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Fruktosa 1,6-bisfosfat aldolase kelas II; komplelks dengan fosfoglikolohidroksamat | |||||||||
| Pengenal pasti | |||||||||
| Simbol | F_bP_aldolase | ||||||||
| Pfam | PF01116 | ||||||||
| Klan Pfam | CL0036 | ||||||||
| InterPro | IPR000771 | ||||||||
| PROSITE | PDOC00523 | ||||||||
| SCOP | 1dos | ||||||||
| SUPERFAMILY | 1dos | ||||||||
| CDD | cd00453 | ||||||||
| |||||||||
Fruktosa-bifosfat aldolase (EC 4.1.2.13), selalunya sekadar aldolase, ialah enzim yang memangkinkan tindak balas berbalik yang membelah aldol, fruktosa 1,6-bisfosfat, kepada triosa fosfat, dihidroksiaseton fosfat (DHAP) dan gliseraldehid 3-fosfat (G3P). Aldolase juga boleh menghasilkan DHAP daripada (3S,4R)-ketosa 1-fosfat lain seperti fruktosa 1-fosfat dan sedoheptulosa 1,7-bisfosfat. Glukoneogenesis dan kitaran Calvin selaku laluan anabolik, mengguna pakai tindak balas terbalik. Glikolisis, sebuah laluan katabolik, menggunakan tindak balas hadapan. Aldolase dibahagikan kepada dua kelas mengikut mekanisme.
Perkataan aldolase juga merujuk secara am kepada mana-mana enzim yang melakukan tindak balas aldol (mencipta aldol) atau sebaliknya (memecahkan aldol), seperti asid sialik aldolase yang membentuk asid sialik.
Mekanisme dan struktur
Protein kelas I membentuk perantaraan bes Schiff terprotonasi yang menghubungkan lisina di tapak aktif yang sangat terpelihara dengan karbon karbonil di DHAP. Selain itu, sisa tirosina adalah penting untuk mekanisme ini sebagai penstabil penerima hidrogen. Protein kelas II menggunakan mekanisme berbeza yang mengutubkan kumpulan karbonil dengan kation divalen seperti Zn2+. Tagatosa-bisfosfat aldolase, protein operon galaktitolEscherichia coli, gatY, dan operon N-asetil galaktosamina operon, agaY ialah homolog kelas II. Dua sisa histidina di separuh pertama urutan homolog ini telah ditunjukkan terlibat dalam mengikat zink.[1]
Subunit protein kedua-dua kelas masing-masing mempunyai domain α/β yang dilipat ke dalam balang TIM yang mengandungi tapak aktif. Beberapa subunit dipasang ke dalam protein lengkap. Kedua-dua kelas berkongsi identiti jujukan yang sedikit.
Dengan beberapa pengecualian, hanya protein kelas I telah ditemui dalam haiwan, tumbuhan dan alga hijau.[2] Dengan beberapa pengecualian, hanya protein kelas II telah ditemui dalam kulat. Kedua-dua kelas telah ditemui secara meluas dalam eukariot lain serta dalam bakteria.[3] Kedua-dua kelas sering hadir bersama dalam organisma yang sama. Tumbuhan dan alga mempunyai aldolase plastid, kadangkala peninggalan endosimbiosis, sebagai tambahan kepada aldolase sitosol biasa. Aldolas/fosfatase fruktosa-bisfosfat dwifungsi dengan mekanisme kelas I telah ditemui secara meluas dalam arkea dan dalam beberapa bakteria.[4] Tapak aktif aldolase arkea ini juga menetap dalam tong TIM.
Dalam glukoneogenesis dan glikolisis
Glukoneogenesis dan glikolisis berkongsi satu siri enam tindak balas boleh balik. Dalam glukoneogenesis, gliseraldehid-3-fosfat diturunkan menjadi fruktosa 1,6-bifosfat dengan aldolase. Dalam glikolisis, fruktosa 1,6-bifosfat dibelah menjadi gliseraldehid-3-fosfat dan fosfat dihidroksiaseton melalui penggunaan aldolase. Aldolase yang digunakan dalam glukoneogenesis dan glikolisis ialah protein sitoplasma.
Tiga bentuk protein kelas I terdapat dalam vertebrata . Aldolase A lebih cenderung hadir dalam otot dan otak; aldolase B dalam hati, buah pinggang dan enterosit; dan aldolase C dalam otak. Aldolase A dan C terlibat terutamanya dalam glikolisis, manakala aldolase B terlibat dalam kedua-dua glikolisis dan glukoneogenesis.[5] Sesetengah kecacatan dalam aldolase B menyebabkan intoleransi fruktosa keturunan. Metabolisme fruktosa bebas dalam hati mengeksploitasi keupayaan aldolase B untuk menggunakan fruktosa 1-fosfat sebagai substrat.[6] Fruktosa-bifosfat aldolase/fosfatase arkea mungkin terlibat dalam glukoneogenesis kerana produknya ialah fruktosa 6-fosfat.[7]
Dalam kitaran Calvin
Kitaran Calvin ialah laluan penetapan karbon; ia merupakan sebahagian daripada fotosintesis yang menukar karbon dioksida dan sebatian lain kepada glukosa. Kitara ini dan glukoneogenesis berkongsi satu siri empat tindak balas berbalik. Dalam kedua-dua laluan, 3-fosfogliserat (3-PGA atau 3-PG) dikurangkan kepada fruktosa 1,6-bifosfat dengan aldolase memangkinkan tindak balas terakhir. Tindak balas kelima, dimangkinkan dalam kedua-dua laluan oleh fruktosa 1,6-bisfosfatase, menghidrolisiskan fruktosa 1-6-bifosfat kepada fruktosa 6-fosfat dan fosfat bukan organik. Penurunan besar dalam tenaga bebas menjadikan tindak balas ini tidak dapat diterbalikkan. Dalam kitaran Calvin, aldolase juga memangkinkan pengeluaran sedoheptulosa 1,7-bifosfat daripada DHAP dan eritrosa 4-fosfat. Produk utama kitaran Calvin ialah triosa fosfat (TP) yang merupakan campuran DHAP dan G3P, dan fruktosa 6-fosfat. Kedua-duanya juga diperlukan untuk menjana semula RuBP. Aldolase yang digunakan oleh tumbuhan dan alga dalam kitaran Calvin biasanya merupakan protein sasaran plastid yang dikodkan oleh gen nukleus.
Reaksi
Aldolase memangkinkan
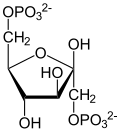
- fruktosa 1,6-bifosfat ⇌ DHAP + G3P
dan juga
- sedoheptulosa 1,7-bifosfat ⇌ DHAP + eritrosa 4-fosfat
- fruktosa 1-fosfat ⇌ DHAP + gliseraldehid
Aldolase digunakan dalam bahagian glukoneogenesis/glikolisis boleh balik
- 2(PEP + NADH + H+ + ATP + H2O) ⇌ fruktosa 1,6-bifosfat + 2(NAD+ + ADP + Pi)
Aldolase juga digunakan dalam bahagian kitaran Calvin yang dikongsi dengan glukoneogenesis, dengan hidrolisis fosfat tak boleh balik pada penghujungnya dimangkinkan oleh fruktosa 1,6-bisfosfatase.
- 2( 3-PG + NADPH + H + + ATP + H2O) ⇌ fruktosa 1,6-bifosfat + 2(NADP + + ADP + Pi)
- fruktosa 1,6-bifosfat + H2O → fruktosa 6-fosfat + Pi
Dalam glukoneogenesis, 3-PG dihasilkan oleh enolase dan fosfogliserat mutase yang bertindak secara bersiri
- PEP + H 2 O ⇌ 2-PG ⇌ 3-PG
Dalam kitaran Calvin, 3-PG dihasilkan oleh RuBisCO
- RuBP + CO 2 + H 2 O → 2(3-PG)
G3P dihasilkan oleh fosfogliserat kinase yang bertindak secara bersiri dengan gliseraldehid-3-fosfat dehidrogenase (GAPDH) dalam glukoneogenesis, dan secara bersiri dengan gliseraldehid-3-fosfat dehidrogenase (NADP+) (berfosforilan) dalam kitaran Calvin.
- 3-PG + ATP ⇌ 1,3-bifosfogliserat + ADP
- 1,3-bifosfogliserat + NAD(P)H + H + ⇌ G3P + Pi + NAD(P)+
Isomerase triose-fosfat mengekalkan DHAP dan G3P dalam keseimbangan yang hampir, menghasilkan campuran yang dipanggil triosa fosfat (TP)
- G3P ⇌ DHAP
Oleh itu, kedua-dua DHAP dan G3P tersedia untuk aldolase.
Sifat sampingan
Aldolase juga telah terlibat dalam banyak fungsi "pencahayaan bulan" atau bukan pemangkin berdasarkan pertalian mengikatnya untuk banyak protein lain termasuk F-aktin, α-tubulin, dinein rantai ringan, WASP, penukar anion Jalur 3, fosfolipase D (PLD2), pengangkut glukosa GLUT4, inositol trisfosfat, V-ATPase dan ARNO (faktor pertukaran nukleotida guanina ARF6). Perkaitan ini dianggap sebahagian besarnya terlibat dalam struktur sel. Bagaimanapun, penglibatan dalam endositosis, pencerobohan parasit, penyusunan semula sitoskeleton, kemotilan sel, perdagangan dan kitar semula protein membran, transduksi isyarat dan pembahagian tisu telah diterokai.[8][9][10]
Rujukan
- ^ Zgiby SM, Thomson GJ, Qamar S, Berry A (2000). "Exploring substrate binding and discrimination in fructose1, 6-bisphosphate and tagatose 1,6-bisphosphate aldolases". Eur. J. Biochem. 267 (6): 1858–68. doi:10.1046/j.1432-1327.2000.01191.x. PMID 10712619.
- ^ Patron NJ, Rogers MB, Keeling PJ (2004). "Gene replacement of fructose-1,6-bisphosphate aldolase supports the hypothesis of a single photosynthetic ancestor of chromalveolates". Eukaryotic Cell. 3 (5): 1169–75. doi:10.1128/EC.3.5.1169-1175.2004. PMC 522617. PMID 15470245.
- ^ Trung Hieu Pham, Shreesha Rao, Ta-Chih Cheng, Pei-Chi Wang, Shih-Chu Chen, The moonlighting protein fructose 1,6-bisphosphate aldolase as a potential vaccine candidate against Photobacterium damselae subsp.
- ^ Siebers B, Brinkmann H, Dörr C, Tjaden B, Lilie H, van der Oost J, Verhees CH (2001). "Archaeal fructose-1,6-bisphosphate aldolases constitute a new family of archaeal type class I aldolase". J. Biol. Chem. 276 (31): 28710–8. doi:10.1074/jbc.M103447200. PMID 11387336.
- ^ Walther EU, Dichgans M, Maricich SM, Romito RR, Yang F, Dziennis S, Zackson S, Hawkes R, Herrup K (1998). "Genomic sequences of aldolase C (Zebrin II) direct lacZ expression exclusively in non-neuronal cells of transgenic mice". Proc. Natl. Acad. Sci. U.S.A. 95 (5): 2615–20. Bibcode:1998PNAS...95.2615W. doi:10.1073/pnas.95.5.2615. PMC 19434. PMID 9482935.
- ^ Gopher A, Vaisman N, Mandel H, Lapidot A (1990). "Determination of fructose metabolic pathways in normal and fructose-intolerant children: a C-13 NMR study using C-13 fructose". Proc. Natl. Acad. Sci. U.S.A. 87 (14): 5449–53. doi:10.1073/pnas.87.14.5449. PMC 54342. PMID 2371280.
- ^ Estelmann S, Hügler M, Eisenreich W, Werner K, Berg IA, Ramos-Vera WH, Say RF, Kockelkorn D, Gad'on N, Fuchs G (2011). "Labeling and enzyme studies of the central carbon metabolism in Metallosphaera sedula". J. Bacteriol. 193 (5): 1191–200. doi:10.1128/JB.01155-10. PMC 3067578. PMID 21169486.
- ^ Rangarajan ES, Park H, Fortin E, Sygusch J, Izard T (2010). "Mechanism of Alolase Control of Sorting Nexin 9 Function in Endocytosis". J. Biol. Chem. 285 (16): 11983–90. doi:10.1074/jbc.M109.092049. PMC 2852936. PMID 20129922.
- ^ Ahn AH, Dziennis S, Hawkes R, Herrup K (1994). "The cloning of zebrin II reveals its identity with aldolase C". Development. 120 (8): 2081–90. doi:10.1242/dev.120.8.2081. PMID 7925012.
- ^ Merkulova M, Hurtado-Lorenzo A, Hosokawa H, Zhuang Z, Brown D, Ausiello DA, Marshansky V (2011). "Aldolase directly interacts with ARNO and modulates cell morphology and acid vesicle distribution". Am J Physiol Cell Physiol. 300 (6): C1442-55. doi:10.1152/ajpcell.00076.2010. PMC 3118619. PMID 21307348.
Pautan luar
 Kategori berkenaan Fruktosa-bisfosfat aldolase di Wikimedia Commons
Kategori berkenaan Fruktosa-bisfosfat aldolase di Wikimedia Commons- Tolan Laboratory at Boston University