
| |
| |

| |

| |
| Nama | |
|---|---|
| Nama IUPAC pilihan
Asid (2Z)-But-2-enedioik | |
| Nama lain
asid butenedioik (Z), asid butenedioik cis, asid malenik, asid maleinik, asid toksilik
| |
| Pengecam | |
Imej model 3D Jmol
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| ECHA InfoCard | 100.003.403 |
| Nombor EC |
|
| KEGG | |
| Nombor RTECS |
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C4H4O4 | |
| Jisim molar | 116.07 g·mol−1 |
| Rupa bentuk | Pepejal putih |
| Ketumpatan | 1.59 g/cm³ [1] |
| Takat lebur | 135 °C (275 °F; 408 K) (terurai)[2] |
| 478.8 g/L at 20 C[2] | |
| Keasidan (pKa) | pka1 = 1.9 pka2 = 6.07 [3] |
| -49.71·10−6 cm3/mol | |
| Bahaya | |
| MSDS | MSDS dari J. T. Baker |
| Pengelasan EU | {{{value}}} |
| Frasa R | R22 R36/37/38 |
| Frasa S | Templat:S2 S26 Templat:S28 Templat:S37 |
| NFPA 704 (berlian api) | |
| Sebatian berkaitan | |
asid karboksilik berkaitan
|
asid fumarik asid suksinik asid krotonik |
Sebatian berkaitan
|
anhidrida maleik maleimide |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
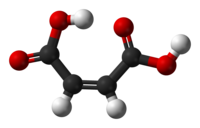
Asid maleik atau asid butenedioik cis ialah sebuah sebatian organik yang merupakan asid dikarboksilik, suatu molekul dengan dua kumpulan karboksil. Formula kimianya ialah HO2CCH=CHCO2H. Asid maleik ialah cis-isomer dari asid butenedioik, manakala asid fumarik ialah isomer trans. Ia kebanyakannya digunakan sebagai pelopor kepada asid fumarik, dan saudara kepada induknya maleik anhidrida, asid maleik ada beberapa penggunaan.
Sifat
Asid maleik lebih larut dalam air daripada asid fumarik dengan nilai keterlarutannya ialah kira-kira 78 g per 100 mL air pada 25 °C. Keterlarutan sebatian ini meningkat secara mendadak seiring dengan peningkatan suhu seperti yang ditunjukkan dalam jadual di bawah:
| Suhu (°C) | 25 | 40 | 60 | 97.5 |
|---|---|---|---|---|
| Keterlarutan (g per 100 mL) | 78.9 | 112.3 | 148.8 | 392.6 |
Sebatian ini boleh terurai apabila dipanaskan pada suhu kira-kira 135 °C kepada maleik anhidrida dengan membebaskan air. Asid maleik boleh bertindak balas dengan molekul ozon lalu menghasilkan asid glioksilik.[5]
Penghasilan
Dalam industri, asik maleik dihasilkan melalui hidrolisis maleik anhidrida yang dihasilkan melalui pengoksidaan benzena atau butana.[4]

Rujukan
- ^ Templat:Merck12th
- ^ a b Templat:GESTIS
- ^ CRC Handbook of Chemistry and Physics, 73rd ed.; CRC Press: Boca Raton, Florida., 1993
- ^ a b K. Lohbeck, H. Haferkorn, W. Fuhrmann, N. Fedke: Maleic and Fumaric Acids. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim, 2012, DOI:10.1002/14356007.a16_053.
- ^ DSM glyoxylic acid production Diarkibkan 2005-11-30 di Wayback Machine
Pautan luar
| Wikimedia Commons mempunyai media berkaitan: Asid maleik. |









