| |

| |
| Nama | |
|---|---|
| Nama IUPAC
Asid (2-hidroksi-3-fosfonooksi-propanoiloksi)fosfonik
| |
| Nama lain
1,3-difosfogliserat; gliserat-1,3-bisfosfat; gliserat-1,3-bifosfat; 1,3-bisfosfogliserat; 3-fosfogliseroil fosfat; asid gliserik-1,3-difosfat
| |
| Pengecam | |
Imej model 3D Jmol
|
|
| Singkatan | 1,3BPG; 1,3-BPG; PGAP |
| ChemSpider | |
PubChem CID
|
|
CompTox Dashboard (EPA)
|
|
| |
| |
| Sifat | |
| C3H8O10P2 | |
| Jisim molar | 266.03 g·mol−1 |
Kecuali jika dinyatakan sebaliknya, data diberikan untuk bahan-bahan dalam keadaan piawainya (pada 25 °C [77 °F], 100 kPa). | |
| | |
| Rujukan kotak info | |
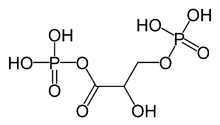
Asid 1,3-bisfosfogliserik (1,3-bisfosfogliserat atau 1,3BPG) ialah molekul organik 3 atom karbon yang terdapat dalam kebanyakan, jika tidak semua, organisma hidup. Ia wujud terutamanya sebagai perantaraan metabolisme dalam kedua-dua glikolisis semasa respirasi, dan kitaran Calvin dalam fotosintesis. 1,3BPG ialah peringkat peralihan antara gliserat 3-fosfat dan gliseraldehid 3-fosfat semasa penetapan/penurunan CO2. 1,3BPG juga merupakan molekul pelopor kepada 2,3-bisfosfogliserat yang seterusnya merupakan perantaraan tindak balas dalam laluan glikolisis.
Struktur dan peranan biologi
1,3-bisfosfogliserat ialah bes konjugat bagi asid 1,3-bisfosfogliserik. Ia terfosforilasi di karbon nombor 1 dan 3. Hasil pemfosforilan ini memberikan 1,3BPG sifat biologi yang penting seperti keupayaan untuk memfosforilasi ADP untuk membentuk molekul simpanan tenaga, ATP.
Glikolisis
| D-gliseraldehid 3-fosfat | gliseraldehid fosfat dehidrogenase | 1,3-bisfosfo-D-gliserat | 3-fosfogliserat kinase | 3-fosfo-D-gliserat | ||

|

|
| ||||
| NAD+ + Pi |
NADH + H+ |
ADP | ATP | |||

|

| |||||
| NAD+ + Pi |
NADH + H+ |
ADP | ATP | |||
| gliseraldehid fosfat dehidrogenase | 3-fosfogliserat kinase | |||||
Seperti yang dinyatakan sebelum ini, 1,3BPG ialah perantaraan metabolisme dalam laluan glikolisis. Ia dicipta oleh pengoksidaan eksergonik aldehid di G3P. Hasil pengoksidaan ini ialah penukaran kumpulan aldehid kepada kumpulan asid karboksilik yang mendorong pembentukan ikatan asil fosfat. Ini secara kebetulan adalah satu-satunya langkah dalam laluan glikolitik di mana NAD+ ditukar kepada NADH. Tindak balas pembentukan 1,3BPG memerlukan kehadiran enzim yang dipanggil gliseraldehid-3-fosfat dehidrogenase.
Ikatan asil fosfat tenaga tinggi 1,3BPG adalah penting dalam respirasi kerana ia membantu dalam pembentukan ATP. Molekul ATP yang dicipta semasa tindak balas berikut ialah molekul ATP pertama yang terjana semasa respirasi. Tindak balas berlaku seperti berikut;
- 1,3-bifosfogliserat + ADP ⇌ 3-fosfogliserat + ATP
Pemindahan fosfat tak organik daripada kumpulan karboksil pada 1,3BPG kepada ADP untuk membentuk ATP boleh diterbalikkan oleh kerana tenaga bebas (ΔG) yang rendah. Ini berlaku akibat daripada satu ikatan asil fosfat terbelah manakala satu lagi tercipta. Tindak balas ini tidak spontan secara semula jadi, dan memerlukan kehadiran mangkin. Peranan ini dilakukan oleh enzim fosfogliserat kinase. Semasa tindak balas, fosfogliserat kinase mengalami perubahan konformasi cetusan substrat dengan cara serupa dengan satu lagi enzim metabolisme lain, heksokinase.
Oleh kerana dua molekul gliseraldehid-3-fosfat terbentuk semasa glikolisis daripada satu molekul glukosa, 1,3BPG boleh dikatakan bertanggungjawab bagi dua daripada 10 molekul ATP yang dihasilkan semasa keseluruhan proses. Glikolisis juga menggunakan dua molekul ATP pada peringkat awalnya sebagai langkah komited dan tidak boleh diterbalikkan. Atas sebab ini, glikolisis tidak boleh diterbalikkan, dan mempunyai hasil bersih 2 molekul ATP dan dua NADH. Kedua-dua molekul NADH itu sendiri terus menghasilkan kira-kira 3 molekul ATP setiap satu.
Kitaran Calvin
1,3-BPG mempunyai peranan yang hampir sama dalam kitaran Calvin dengan peranannya dalam laluan glikolisis. Atas sebab ini, kedua-dua tindak balas dikatakan serupa. Walau bagaimanapun, laluan tindak balas ini diterbalikkan. Satu-satunya perbezaan utama yang lain antara kedua-dua tindak balas ialah NADPH digunakan sebagai penderma elektron dalam kitaran Calvin manakala NAD+ digunakan sebagai penerima elektron dalam glikolisis. Dalam kitaran tindak balas ini, 1,3BPG berasal daripada 3-fosfogliserat, dan ditukar menjadi gliseraldehid 3-fosfat oleh tindakan enzim tertentu.
Bertentangan dengan tindak balas yang sama bagi laluan glikolitik, 1,3BPG dalam kitaran Calvin tidak menghasilkan ATP, tetapi menggunakannya. Atas sebab ini, ia boleh dianggap sebagai langkah yang tidak boleh diterbalikkan dalam kitaran. Hasil daripada bahagian kitaran ini ialah fosfat tak organik dikeluarkan daripada 1,3BPG sebagai ion hidrogen, dan dua elektron ditambah kepada sebatian.
Dalam gaya yang terbalik dengan glikolisis, enzim fosfogliserat kinase memangkinkan penurunan kumpulan karboksil 1,3BPG untuk membentuk aldehid sebaliknya. Tindak balas ini juga membebaskan molekul fosfat tak organik yang kemudiannya digunakan sebagai tenaga untuk pendermaan elektron daripada penukaran NADPH kepada NADP+. Enzim yang mengawasi peringkat terakhir tindak balas ini ialah enzim gliseraldehid-fosfat dehidrogenase.
Pemindahan oksigen
Semasa metabolisme normal manusia, kira-kira 20% daripada 1,3BPG yang dihasilkan tidak pergi lebih jauh dalam laluan glikolisis. Ia sebaliknya dihalang melalui laluan alternatif yang melibatkan penurunan ATP dalam sel darah merah. Dalam laluan alternatif ini, ia ditukra menjadi molekul serupa yang dipanggil asid 2,3-bisfosfogliserik (2,3BPG). 2,3BPG digunakan sebagai mekanisme untuk mengawasi pembebasan oksigen yang cekap daripada hemoglobin. Tahap 1,3BPG ini akan meningkat dalam darah pesakit apabila tahap oksigen rendah kerana ini adalah salah satu mekanisme penyesuaian diri. Tahap oksigen yang rendah mencetuskan kenaikan paras 1,3BPG yang seterusnya meningkatkan tahap 2,3BPG lalu mengubah kecekapan pemisahan oksigen daripada hemoglobin.
Rujukan
- Alberts, Bruce; dll. (2001). Molecular Biology of the Cell. New York: Garland Science. ISBN 0-8153-4072-9.
- Germann, William J.; Stanfield, Cindy L. (2002). Principles of Human Physiology. San Francisco: Benjamin Cummings. ISBN 0-8053-6056-5.
- Stryer, Lubert; dll. (2002). Biochemistry (ed. 5th). New York: W. H. Freeman. ISBN 0-7167-4684-0.


















